近日,深圳大學醫學部朱衛國教授課題組在國際知名雜志Cell Research(影響因子15.6)上以研究長文形式在線發表了題為“Destabilizationof linker histone H1.2 is essential for ATM activation and DNA damage repair”的原創研究成果,揭示了連接組蛋白H1.2調節DNA損傷應答與修復核心激酶ATM活性的分子機制。該報道首次發現組蛋白H1的染色質脫離和特異性降解過程,并將這一過程與ATM激活和DNA損傷修復相關聯,從而闡明了DNA損傷誘導ATM激活的新機制。
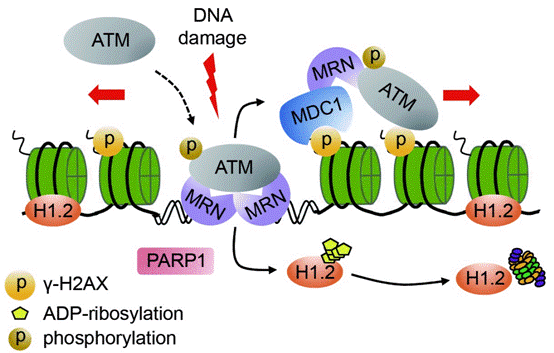
機體細胞在內外源各種刺激的影響下,時刻都會產生大量DNA損傷。根據DNA損傷部位、類型和嚴重程度等的不同,細胞啟動不同的應答與修復機制,從而維持遺傳物質完整性和基因組穩定性。一旦DNA損傷不能適時正確地修復,將會引起細胞內一系列的功能紊亂,嚴重時則會導致細胞的癌變與凋亡。核小體作為構成真核細胞染色質的最基本單位,由形成八聚體的核心組蛋白(H2A,H2B,H3,H4)和DNA組成。連接組蛋白H1,作為核小體間的結構性蛋白,主要參與染色質高級結構的維持與穩定。核心組蛋白及其修飾已被大量報道參與DNA損傷應答與修復過程,但連接組蛋白H1是否,以及如何參與這一過程仍需要進一步研究。
本文采用了基因編輯技術,將H1的幾個變體在腫瘤細胞中分別進行敲除,以此出發去探討H1在DNA損傷修復以及調節ATM激活中的作用。研究人員發現,連接組蛋白H1的變體H1.2可以特異性地抑制ATM的活性,而其他變體,如H1.3和H1.4則沒有這樣的作用。H1.2可以直接與ATM相互作用,干擾ATM與底物和MRN(MRE11-RAD50-NBS1)復合物的結合,從而抑制ATM的激活與招募。在DNA雙鏈斷裂損傷時,H1.2快速從染色質損傷位點脫落,并進一步被蛋白酶體降解。H1.2的這一快速染色質脫離過程受到PARP1介導的多聚ADP核糖基化修飾調節。進一步的位點突變實驗鑒定出這一修飾位點主要發生在H1.2羧基端的188位絲氨酸上。而將PARP1抑制或敲除,或對H1.2的絲氨酸188位進行突變,都會抑制H1.2從染色質上脫離,進而抑制ATM的激活,并引起腫瘤細胞的DNA損傷修復能力和生存能力下降。此外,該報道還發現氯化鈉和組蛋白去乙酰化酶抑制劑等非DNA損傷刺激也能激活ATM,同時伴隨著H1.2的特異性降解,提示H1.2對于ATM激活的調控具有更廣泛的意義。
論文主要由朱衛國教授課題組博士生李治明和李瑩璐完成,二人并列第一作者。深圳大學為唯一通訊作者單位。該研究依托深圳大學醫學部和北京大學醫學部的研究平臺,獲得了國家重點研發計劃、國家基金委和深圳市科創委的大力支持。
(醫學部 供稿)