近日,深圳大學、上海交通大學與美國威斯康辛大學、亞利桑那州立大學等多個課題組組建的國際合作團隊,通過多年深入深度交叉,率先發現并揭示了DNA納米結構可以在動物腎臟高效特異性蓄積的特性,發展出新型納米診療技術用于急性腎損傷的預防和治療。相關研究成果于11月8日在線發表于《自然-生物醫學工程》雜志(Nature Biomedical Engineering, 2018, doi: 10.1038/s41551-018-0317-8)。該合作團隊中,江大衛博士、葛志磊博士和任炯俊博士(現為韓國首爾國立大學助理教授)為論文共同第一作者,美國威斯康辛大學蔡偉波教授與深圳大學黃鵬教授,亞利桑那州立大學顏顥教授,上海交通大學樊春海教授為共同通訊作者。
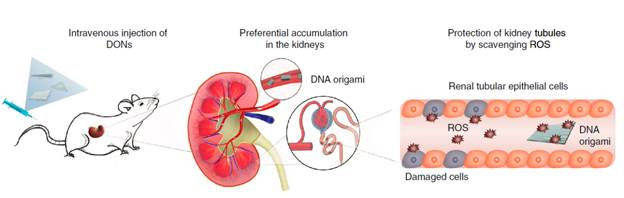
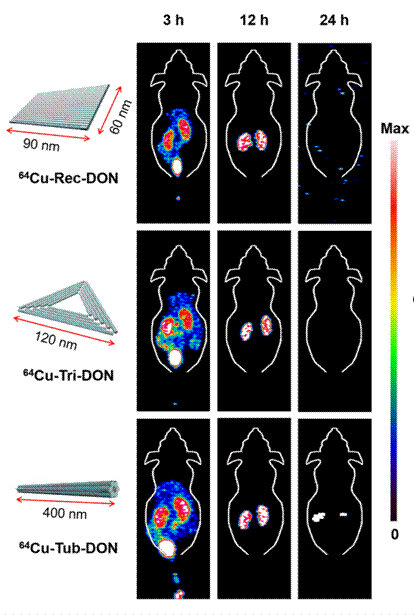
急性腎損傷又名急性腎衰竭,全球范圍每年新增病例高達1330萬,死亡病例達到170萬(根據2015年《The Lancet》《柳葉刀》雜志報道的統計數據)。目前,對于急性腎損傷,臨床上尚沒有很好的治療方法。DNA納米結構是一類利用DNA互補配對原則設計得到的自組裝分子結構。該合作團隊研究人員利用放射性同位素Cu-64分別標記了三種不同尺寸和形狀的自組裝DNA納米結構,包括方塊DNA折紙(90x60 nm),三角形DNA折紙(邊長120 nm)和棒狀DNA折紙(400 x 7nm)。他們通過正電子發射斷層成像(Positron emission tomography, PET)觀察和研究它們在小鼠體內的吸收、代謝、分布和排泄(ADME)。研究結果表明三種DNA納米結構都在小鼠的腎臟高效特異性蓄積,攝取量高達~20%ID/g,顯著高于常見的小分子藥物和類似尺寸的納米顆粒(通常< 5 %id/g)。
這種納米診療新技術利用了DNA納米結構在腎臟的高攝取的特性,以及DNA本身所具有的抗氧化劑功能,有望實現對急性腎衰的有效保護。研究人員構建了小鼠急性腎衰模型,然后通過小鼠尾靜脈注射一定劑量的DNA納米結構,發現可以有效緩解小鼠的腎衰癥狀,使血液中的肌酐及尿素含量顯著降低至正常水平。進一步的生物毒性和生物相容性研究表明,DNA納米結構在活體內并沒有引發免疫反應,具有很好的生物安全性和組織兼容性。該研究為急性腎損傷提供了一種安全有效的抗氧化療法,并拓寬了DNA納米技術在納米診療中的應用范圍。
論文原文鏈接:https://www.nature.com/articles/s41551-018-0317-8

(醫學部 供稿)