2024年5月,深圳大學醫學部許興智教授團隊在國際頂級期刊Autophagy發表題為“VCP/p97 UFMylation stabilizes BECN1 and facilitates the initiation of autophagy”的研究論文。這是許興智教授團隊繼2019年首次詮釋UFMylation在DNA損傷應答(DDR)中促進DDR核心激酶ATM活化和上月(2024年4月)揭示UFMylation維持被阻滯復制叉穩定性的分子機制后,再次率先揭示了UFMylation促進細胞自噬的作用機理。深圳大學醫學部助理教授王志峰博士為第一作者,王志峰助理教授和許興智教授為共同通訊作者,深圳大學為第一單位。

細胞自噬(Autophagy)是真核生物中進化保守的、對細胞內物質進行周轉的重要過程。該過程中一些受損蛋白或細胞器被膜性小泡(自噬小泡)包裹后,與溶酶體(或液泡)融合并降解,從而得以循環利用。自噬過程與癌癥、帕金森綜合征和II-型糖尿病等老年疾病密切相關。猶素(UFM1)作為最晚被發現的類泛素蛋白,已被證明在胚胎發育、內質網穩態、蛋白質量控制、DDR等生命活動中起重要作用,然而在細胞自噬中的功能尚不清楚。在該研究中,許教授團隊發現轉位酶VCP/p97的109位賴氨酸(K109)發生UFMylation,該修飾一方面促進去泛素化酶ATXN3對BECN1的去泛素化作用,從而抑制BECN1蛋白降解,導致BECN1蛋白大量累積。作為自噬的重要起始因子,BECN1可以介導PtdIns3K復合物的形成。另一方面,UFMylation穩定VCP/p97作為支架蛋白的作用直接促進PtdIns3K復合物的形成,最終起始自噬。該研究成果揭示了UFMylation通過促進VCP/p97-ATXN3-BECN1-PtdIns3K軸起始細胞自噬的作用機理,為腫瘤、帕金森綜合征和II-型糖尿病等老年疾病的診治提供了新的思路和策略。
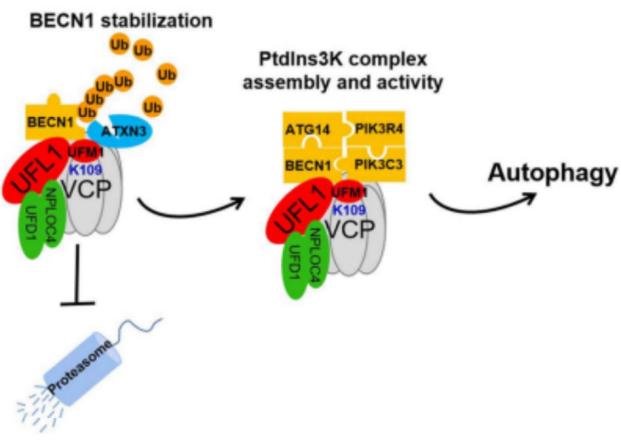
該研究依托廣東省基因組穩定性與疾病防治重點實驗室平臺,馬歇爾生物醫學工程實驗室卡爾森國際腫瘤中心,并獲得了國家自然科學基金和國家重點研發計劃的資助。
原文鏈接:https://doi.org/10.1080/15548627.2024.2356488
同時,許教授團隊的另一項研究(PTIP UFMylation promotes replication fork degradation in BRCA1-deficient cells)也于近期發表在國際知名期刊Journal of Biological Chemistry,該研究發現在BRCA1基因缺陷細胞中,染色質調節因子Pax2反式激活結構域互作蛋白PTIP的UFMylation促進了新生DNA在被阻滯復制叉上的末端切除和降解,從而產生化療抗性。深圳大學醫學部博士后檀群松博士為第一作者,許興智教授為通訊作者,深圳大學為第一單位。
原文鏈接:https://doi.org/10.1016/j.jbc.2024.107312





